La Agencia Española de Medicamentos y Productos Sanitarios detecta dos irregularidades más en la producción de la empresa B. Braun
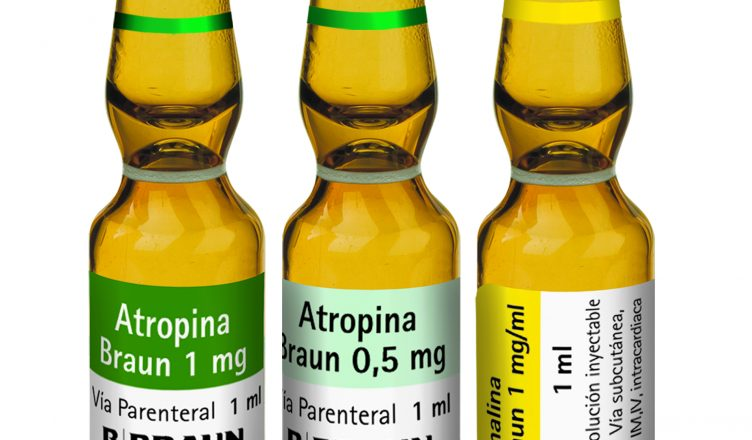
Por un lado, la AEMPS ha ordenado la retirada de Atropina B. Braun 1 mg/ml, solución inyectable, 100 ampollas de 1ml (NR: 27535, CN: 635649), correspondiente al lote 2112112, que caduca el 29 de febrero de 2024.
El organismo sanitario también ha ordenado la retirada de Escopolamina B. Braun 0,5 mg/ml, solución inyectable, 100 ampollas de 1ml (NR: 64566, CN: 608042), correspondiente al lote 2210212, cuya fecha de caducidad es el 28 de febrero de 2025.
Los dos medicamentos han sido fabricados por B. Braun Medical, S. A., con sede en Ronda de los Olivares (Jaén). La empresa alemana B. Braun Melsungen AG tiene otra fábrica en Rubí (Barcelona), donde la semana pasada también se detectaron irregularidades en la elaboración de otros medicamentos.
La AEMPS señala que el motivo de la retirada de estos dos medicamentos se debe a un defecto detectado en «la realización del ensayo de esterilidad», pues «no cumple con los requisitos establecidos en la Farmacopea Europea«.
El prospecto de la Atropina especifica que el fármaco se emplea «como coadyuvante en el tratamiento del síndrome del intestino irritable (colon irritable, colitis mucosa y colon espástico)».
En cuanto a la Escopolamina, el organismo apunta que se emplea «como premedicación en la anestesia para reducir la salivación excesiva y las secreciones del tracto respiratorio».
R27_2023_Alerta_BraunLa AEMPS clasifica los defectos de calidad de los medicamentos en tres categorías (1, 2 y 3). La primera de ellas corresponde con un riesgo muy elevado y la clase 3 con un menor riesgo. En este caso, apunta a que se trata de un defecto de clase 2, de gravedad intermedia, pero precisan que este defecto de calidad «no supone un riesgo vital para los pacientes».
Además de ordenar la retirada del mercado de todas las unidades distribuidas del lote afectado y su devolución al laboratorio por los cauces habituales, el organismo insta a las comunidades autónomas (a las consejerías de Salud de cada gobierno autonómico) a hacer un seguimiento de esta retirada.
Un año repleto de irregularidades
Esta empresa alemana lleva una trayectoria preocupante en la fabricación de medicamentos y productos sanitarios desde el año pasado. En la alerta sanitaria de la pasada semana, los lotes de los medicamentos retirados del mercado eran inyectables y tenían los siguientes nombres: Ibuprofeno, Paracetamol, Amikacina Sulfato, Fluconazol, Ondansetron Hidrocloruro Dihidrato, Sodio Cloruro, Gentamicina, Glucosa Anhidra, Glucosa Monohidrato y Metronidazol.
La agencia recibió el 17 de julio de 2023 información relativa a un defecto de calidad del medicamento veterinario FisioVet solución para perfusión, con número de registro 1162 ESP. El día 21 de julio, el titular de la autorización de comercialización del citado medicamento solicitó la retirada del mercado del lote 21244402 hasta el nivel de mayoristas, minoristas y veterinarios.
En consecuencia y tras evaluar la información aportada y las comprobaciones oportunas, la AEMPS comunicó que, con fecha 27 de julio de 2023, ha decretado la alerta de calidad VDC 03/2023, ordenando la retirada del lote 21244402 del medicamento veterinario FisioVet solución para perfusión (nº reg. 1162 ESP) a B. Braun VetCare, como responsable de la comercialización.
Suero fisiológico con fugas en la base del frasco
A finales de septiembre de 2022, la AEMPS anunció la retirada de un lote de suero fisiológico de B. Braun. Se trataba del siguiente producto: Fisiológico B. Braun 0,9% Solución para perfusión. Este medicamento es una solución de cloruro sódico que se administra mediante una vía colocada en una vena (gotero intravenoso). Contiene cloruro sódico a una concentración similar a la de las sales de la sangre. El organismo anunció que el motivo de esta retirada era la «detección de algunas unidades con fugas en la base del frasco».
La Agencia Española de Medicamentos y Productos Sanitarios, como agencia estatal adscrita al Ministerio de Sanidad, es responsable de garantizar a la sociedad, desde la perspectiva de servicio público, la calidad, seguridad, eficacia y correcta información de los medicamentos y productos sanitarios, desde su investigación hasta su utilización, en interés de la protección y promoción de la salud de las personas, de la sanidad animal y del medioambiente.



No hay ningún riesgo para pacientes . En Industria Farmacéutica se toman medidas muy rigurosas y de retiradas de lotes de producto por precaución y/o por algún defecto en algunas unidades . Esto no se hace en otros productos y actividades. Para estos casos menores, deberían entenderse las retiradas de mercado como muestra de rigor y excelencia y no como alarmas sanitarias en publicaciones con poco conocimiento del tema.